Вакцинація – процес, який породжує безліч суперечок. Хтось вважає її єдиним шляхом подолання пандемії, інші ж називають «всесвітньою змовою». Тим не менше, над процесом розробки та вдоскалення вакцини проти COVID-19 тисячі вчених працюють досі.
Який механізм дії існуючих вакцин? Наскільки ефективними та надійними вони є в Україні? Про особливості їх створення та застосування читайте у матеріалі Ігоря Бартківа.

Вакцина проти COVID-19 — це вакцина, призначена для забезпечення набутого імунітету проти важкого гострого респіраторного синдрому коронавірусу 2 (SARS-CoV-2), вірусу, що викликає коронавірусну хворобу 2019 (COVID-19). До пандемії COVID-19 існували загальні відомості про структуру та функції коронавірусів, що викликають такі захворювання, як важкий гострий респіраторний синдром (ГРВІ/SARS) та Близькосхідний респіраторний синдром (МЕРС/MERS), що дозволило пришвидшити розвиток різних вакцинних технологій на початку 2020 р. 10 січня 2020 року дані про генетичну послідовність SARS-CoV-2 були передані через GISAID (глобальна наукова ініціатива та першоджерело, створене у 2008 році, що забезпечує відкритий доступ до геномних даних вірусів грипу та коронавірусу, відповідального за пандемію COVID-19), і до 19 березня 2020 року світова фармацевтична промисловість оголосила про своє головне зобов'язання вирішити проблему COVID-19.
Розробка вакцин проти COVID-19 мала кілька унікальних проблем.
Невідкладність створення вакцини проти COVID-19 призвела до стиснених графіків, що скоротили стандартні терміни розробки вакцин, в деяких випадках поєднуючи етапи клінічних випробувань протягом місяців, процес, який зазвичай проводився послідовно протягом багатьох років.
Графіки проведення клінічних досліджень, зазвичай послідовний процес, що вимагає років, було стиснено в кілька місяців одночасних випробувань щодо безпеки, ефективності та дозування, що потенційно могло створити нові загрози. Швидкий розвиток та терміновість виробництва вакцини проти пандемії COVID-19 можуть збільшити ризики та рівень невдач із виготовлення безпечної, ефективної вакцини.
Вакцини повинні пройти кілька етапів клінічних випробувань для перевірки безпеки, імуногенності, ефективності, рівня доз та побічних ефектів. Розробники вакцин повинні інвестувати ресурси на міжнародному рівні, щоб знайти достатньо учасників для клінічних випробувань фази II – III, коли вірус виявився «рухомою мішенню» зміни швидкості передачі інфекції між країнами та всередині них, що змусило компанії конкурувати за учасників випробувань.
ТИПИ ВАКЦИН

Концептуальна схема, що демонструє три типи вакцин для формування білків SARS-CoV-2 для стимулювання імунної відповіді: (1) вакцина проти РНК, (2) вакцина до субодиниць, (3) вакцина проти вірусного вектора
Станом на січень 2021 року дев'ять різних технологічних платформ перебували у стадії досліджень і розробок для створення ефективної вакцини проти COVID-19. Більшість платформ кандидатів на вакцини в клінічних випробуваннях зосереджені на протеїні коронавірусу та його варіантах як первинному антигені інфекції COVID-19. Платформи, що розроблялися у 2020 році, включали технології нуклеїнових кислот (модифіковані нуклеозидами «месенджери» РНК та ДНК), не реплікативні вірусні вектори, пептиди, рекомбінантні білки, живі атенуйовані віруси та інактивовані віруси.
Багато технологій вакцин, що розробляються для COVID-19, не схожі на вакцини, які вже використовуються для профілактики грипу, а скоріше використовують стратегії "наступного покоління" для точності виявлення механізмів зараження COVID-19.

РНК вакцини
Схема дії РНК-вакцини. РНК-месенджер, що міститься у вакцині, потрапляє в клітини і перетворюється на чужорідні білки, що викликають імунну відповідь.
РНК-вакцина містить РНК, яка при введенні в тканину діє як месенджер-РНК (мРНК), щоб змусити клітини формувати чужорідний білок і стимулювати адаптивну імунну відповідь, яка вчить організм ідентифікувати та знищити відповідний патоген або ракові клітини. РНК-вакцини часто, але не завжди, використовують модифіковану нуклеозидами РНК. Доставка мРНК досягається спільним формулюванням молекули в наночастинки ліпідів, які захищають нитки РНК і сприяють їх абсорбції в клітинах.
РНК-вакцини були першими вакцинами проти COVID-19, які були дозволені у Великобританії, США та Європейському Союзі. Станом на січень 2021 року дозволеними вакцинами цього типу є вакцина Pfizer-BioNTech COVID-19 та вакцина Moderna COVID-19.
Сильні алергічні реакції трапляються рідко. У грудні 2020 року після введення 1893 360 перших доз вакцини Pfizer-BioNTech COVID-19 виникло до 175 випадків важкої алергічної реакції, з яких 21 — анафілаксії. Для 4 041 396 введених доз вакцин Moderna COVID-19 у грудні 2020 року та січні 2021 року було зареєстровано лише десять випадків анафілаксії. Наночастинки ліпідів, швидше за все, відповідальні за алергічні реакції.
Аденовірусні векторні вакцини
Ці вакцини є прикладами не здатних до реплікації вірусних векторних вакцин із використанням аденовірусної оболонки, яка містить ДНК, що кодує білок SARS-CoV-2. Вакцини проти вірусу COVID-19 на основі вірусних векторів не реплікуються, це означає, що вони не утворюють нових частинок вірусу, а виробляють лише той антиген, який викликає системну імунну відповідь.
Станом на січень 2021 року дозволеними вакцинами цього типу є вакцини Oxford-AstraZeneca COVID-19, вакцина Sputnik V COVID-19, Convidecia та COVID-19 Johnson & Johnson вакцина.
Convidecia та вакцина Johnson & Johnson COVID-19 — це одноразова вакцина, яка пропонує менш складну логістику і може зберігатися в звичайному холодильнику протягом декількох місяців.
Вакцина Sputnik V COVID-19 використовує Ad26 для першої дози, що відповідає єдиній дозі вакцини Johnson & Johnson, та Ad5 для другої дози. Convidecia використовує Ad5 як єдину дозу.
Інактивовані вірусні вакцини
Інактивовані вакцини складаються з частинок вірусу, які вирощували в культурі, а потім вбивали за допомогою такого методу, як нагрівання або формальдегід, щоб втратити здатність до хвороби, одночасно стимулюючи імунну відповідь.
Станом на січень 2021 року дозволеними вакцинами цього типу є китайські CoronaVac, BIBP-CorV, та WIBP-CorV; індійський Covaxin; та російський CoviVac.
Субодиничні вакцини
Субодиничні вакцини представляють один або кілька антигенів без введення цілих частинок патогенів. Залученими антигенами часто є білкові субодиниці, але це може бути будь-яка молекула, яка є фрагментом збудника.
Станом на квітень 2021 року двома дозволеними вакцинами цього типу є пептидна вакцина EpiVacCorona та RBD-Dimer. Вакцини з дозволами, що очікують на розгляд, включають вакцину Novavax COVID-19, [SOBERANA 02 (кон'югована вакцина) та вакцину Sanofi – GSK. Раніше вакцина V451 проходила клінічні випробування, які були припинені, оскільки було виявлено, що вакцина може потенційно спричинити неправильні результати для подальшого тестування на ВІЛ.
Інші типи
Додаткові типи вакцин, які проходять клінічні випробування, включають вірусоподібні вакцини проти часток, багаторазові плазмідні вакцини ДНК, щонайменше, дві лентівірусні вакцини, кон'югована вакцина та вірус везикулярного стоматиту, що демонструє спайковий білок SARS-CoV-2.
Оральні вакцини та інтраназальні вакцини розробляються та вивчаються.
Вчені також досліджували, чи можуть існуючі вакцини для неспоріднених станів підготувати імунну систему та зменшити тяжкість зараження COVID-19. Існують експериментальні докази того, що вакцина БЦЖ проти туберкульозу має неспецифічний вплив на імунну систему, але немає доказів того, що ця вакцина ефективна проти COVID-19.
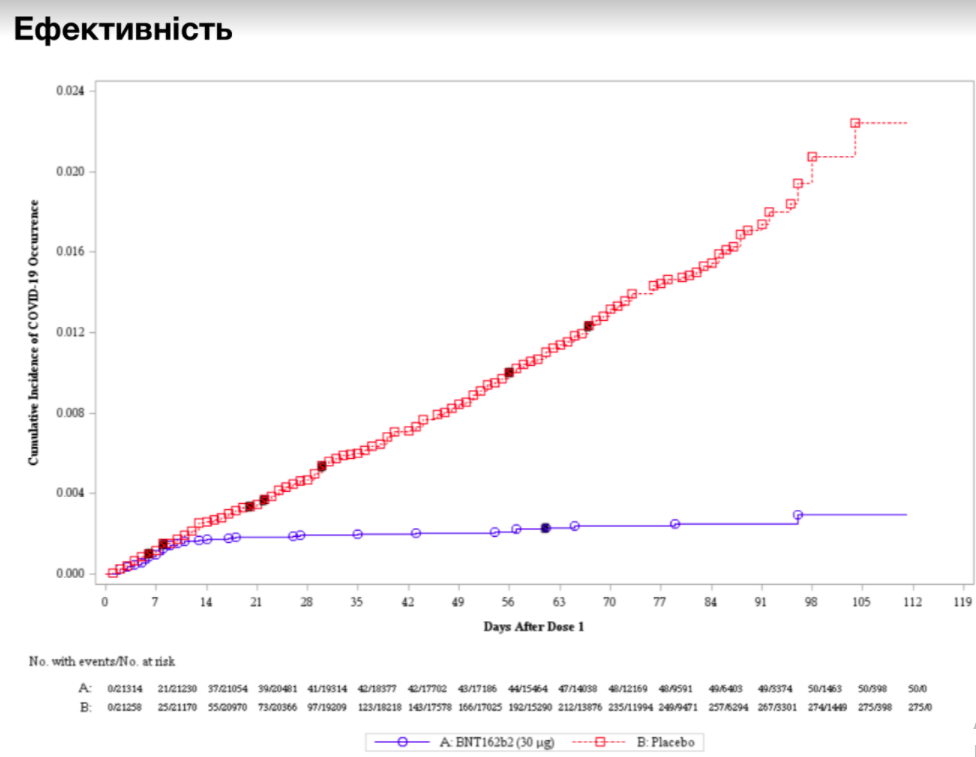
Ефективність
Криві кумулятивної захворюваності на симптоматичні інфекції COVID-19 після першої дози вакцини Pfizer-BioNTech (тозінамеран) або плацебо у подвійному сліпому клінічному дослідженні. (червоний: плацебо; синій: тозінамеран)
Ефективність вакцини — це ризик зараження вакцинованими учасниками контрольованого дослідження порівняно з ризиком зараження невакцинованими учасниками. Ефективність 0% означає, що вакцина не діє (ідентично плацебо). Ефективність 50% означає, що випадків зараження вдвічі менше, ніж у невакцинованих осіб.
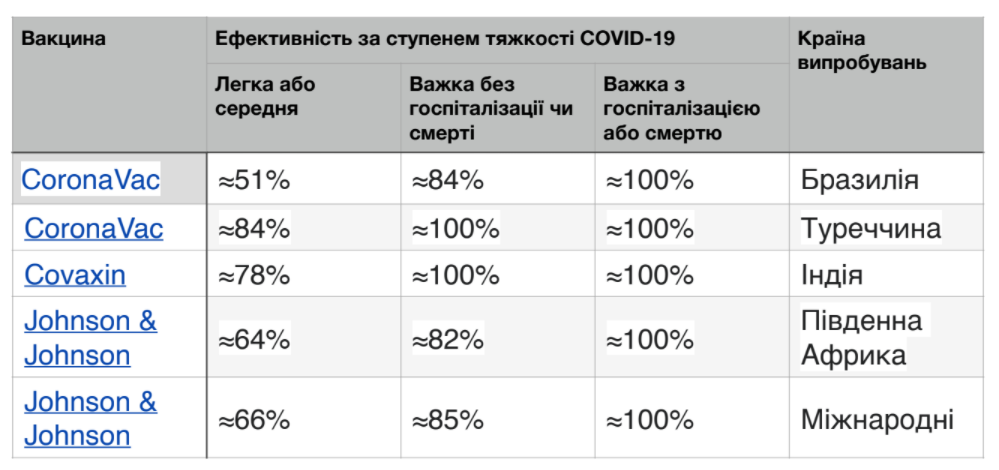
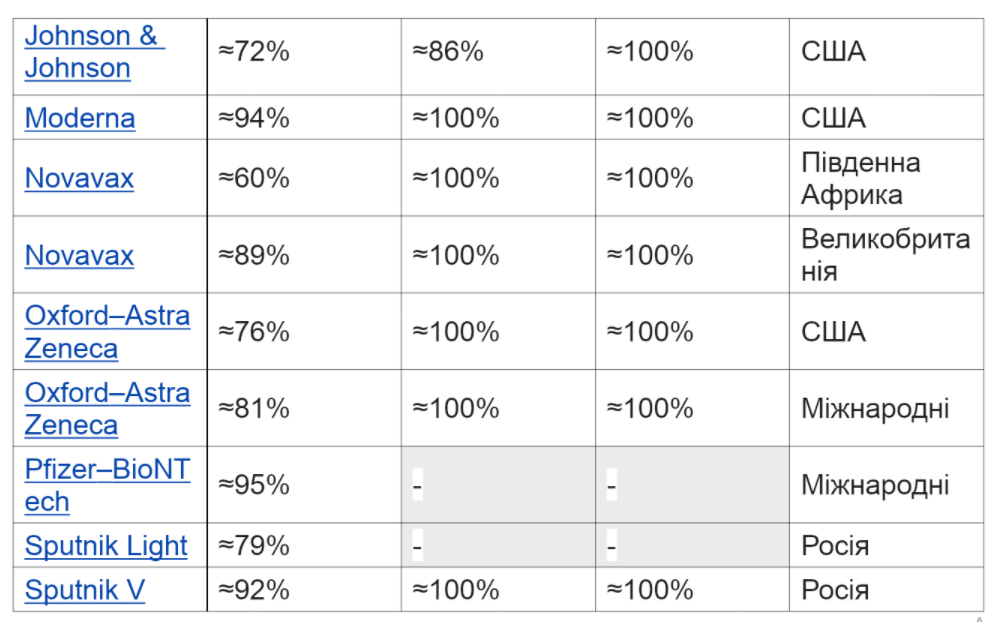
Варіанти
Потенційна поява варіанта SARS-CoV-2, який є помірно або повністю стійким до реакції антитіл, викликаної сучасним поколінням вакцин COVID-19, може вимагати модифікації вакцин. Випробування показують, що багато вакцин, розроблених для початкового штаму, мають меншу ефективність для деяких варіантів проти симптоматичного COVID-19. Станом на лютий 2021 року Управління з контролю за продуктами та ліками США вважало, що всі дозволені FDA вакцини залишаються ефективними у захисті від циркулюючих штамів SARS-CoV-2.
Дезінформація
Активісти проти вакцинації та інші люди поширюють різноманітні чутки, включаючи надмірні заяви про побічні ефекти, історії про поширення COVID-19 дитячими вакцинами, спотворення про те, як працює імунна система, а також коли і як роблять вакцини проти COVID-19.
2 лютого 2020 року Всесвітня організація охорони здоров'я (ВООЗ) описала "масову інфодемію", посилаючись на надмірну кількість повідомлень, яка була неправдивою, про вірус, що значно "ускладнило пошук людьми надійних джерел та надійних вказівок, коли їм це потрібно". ВООЗ заявила, що високий попит на своєчасну та надійну інформацію спонукав до створення прямої гарячої лінії ВООЗ, що працює цілодобово та без вихідних, про міфи, де її групи з питань комунікації та соціальних медіа стежать і реагують на дезінформацію через свій веб-сайт та сторінки в соціальних мережах. ВООЗ спеціально спростувала кілька тверджень як неправдиві, включаючи твердження, що людина може сказати, чи є у неї вірус просто затамувавши подих; твердження, що вживання великої кількості води захистить від вірусу; і твердження, що полоскання горла солоною водою запобігає зараженню.
Вакцинація від коронавірусу в Україні
останнє оновлення: 19.05.2021 14:26
Вакцинація від коронавірусу в Україні в Україні почалася 24.02.2021
В Україні схвалено такі вакцини проти COVID-19:
-
Oxford/AstraZeneca
-
Pfizer/BioNTech
-
Sinovac
Oxford–AstraZeneca COVID-19
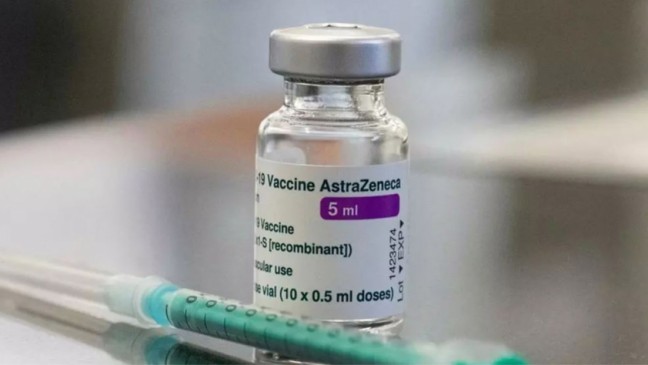
Вакцина Oxford-AstraZeneca COVID-19 під кодовою назвою AZD1222, що продається під торговими марками Covishield та Vaxzevria, є вірусною векторною вакциною для профілактики COVID-19. Розроблена Оксфордським університетом та компанією AstraZeneca, її вводять внутрішньом’язово, використовуючи в якості вектора модифікований аденовірус шимпанзе ChAdOx1. Ефективність вакцини становить 76,0% при запобіганні симптоматичному COVID-19, починаючи з 22 дня після першої дози та 81,3% після другої дози.
Вакцина має хороший профіль безпеки, з побічними ефектами, включаючи біль у місці ін’єкції, головний біль та нудоту, які зазвичай проходять протягом декількох днів. Рідше може спостерігатися анафілаксія (Агентство регулювання лікарських засобів та медичних товарів Великобританії (MHRA) має 268 повідомлень із приблизно 21,2 мільйона щеплень станом на 14 квітня 2021 року). У дуже рідкісних випадках (приблизно у 1 на 100 000 осіб) вакцина асоціюється з підвищеним ризиком утворення тромбів у поєднанні з низьким рівнем тромбоцитів у крові. За даними Європейського агентства з лікарських засобів станом на 4 квітня 2021 року, з Європейського економічного простору та Великобританії було зареєстровано 222 випадки утворення тромбів, в той час як вакцину отримали близько 34 мільйонів людей.
30 грудня 2020 року вакцина була вперше схвалена для використання у програмі вакцинації Великобританії, а перша вакцинація поза випробуванням була проведена 4 січня 2021 року. З тих пір вакцина була схвалена кількома медичними установами по всьому світу, наприклад, Європейським агентством з лікарських засобів (EMA) та Австралійським управлінням терапевтичних товарів, її було затверджено до Списку невідкладних випадків використання Світовою організацією охорони здоров’я. Деякі країни обмежили її використання виключно людьми похилого віку через підвищений ризик важкої хвороби COVID-19 через побоювання щодо дуже рідкісних побічних ефектів вакцини у молодих людей.
Ліки вводять у вигляді двох доз по 0,5 мл, що вводяться внутрішньом’язово в дельтоподібний м’яз (надпліччя) з інтервалом від чотирьох до дванадцяти тижнів, причому ВООЗ рекомендує, щоб другу давали через 8–12 тижнів після першої для оптимальної ефективності.
Побічні ефекти
Найпоширеніші побічні ефекти у клінічних випробуваннях, як правило, були легкими або середніми та покращувались протягом декількох днів після щеплення.
Блювота, діарея, набряк, почервоніння в місці ін’єкції та низький рівень тромбоцитів у крові спостерігались менше, ніж у 1 із 10 осіб. Збільшення лімфатичних вузлів, зниження апетиту, запаморочення, сонливість, пітливість, біль у животі, свербіж та висип спостерігались менше ніж у 1 із 100 людей.
У дуже рідкісних випадках (близько 1 із 100 000 людей) вакцина може призвести до утворення тромбів у поєднанні з низьким рівнем тромбоцитів у крові. MHRA Великобританії станом на 14 квітня 2021 року повідомляє про загальну частоту випадків тромбоемболічних подій із одночасними низькими тромбоцитами 7,9 на мільйон доз (менше 1 на 100 000 людей).
Як і в інших вакцин, анафілаксія та інші алергічні реакції є відомим побічним ефектом ADZ1222, тому її слід вводити під пильним контролем. Європейське агентство з лікарських засобів (EMA) оцінило 41 випадок анафілаксії з приблизно 5 мільйонів щеплень у Великобританії.
Виробництво
Вакцина стабільна при температурі холодильника і коштує від 3 до 4 доларів США за дозу. 17 грудня 2020 року в твіті державного секретаря бюджету Бельгії було виявлено, що Європейський Союз (ЄС) заплатить 1,78 євро (2,16 доларів США) за дозу. The New York Times припускає, що нижча ціна може стосуватися факторів, включаючи інвестиції в інфраструктуру виробництва вакцин ЄС.
Станом на березень 2021 року вакцинна діюча речовина (ChAdOx1-SARS-COV-2) виробляється на декількох об'єктах у всьому світі, а AstraZeneca стверджує, що створила 25 місць у 15 країнах.
Pfizer – BioNTech COVID-19
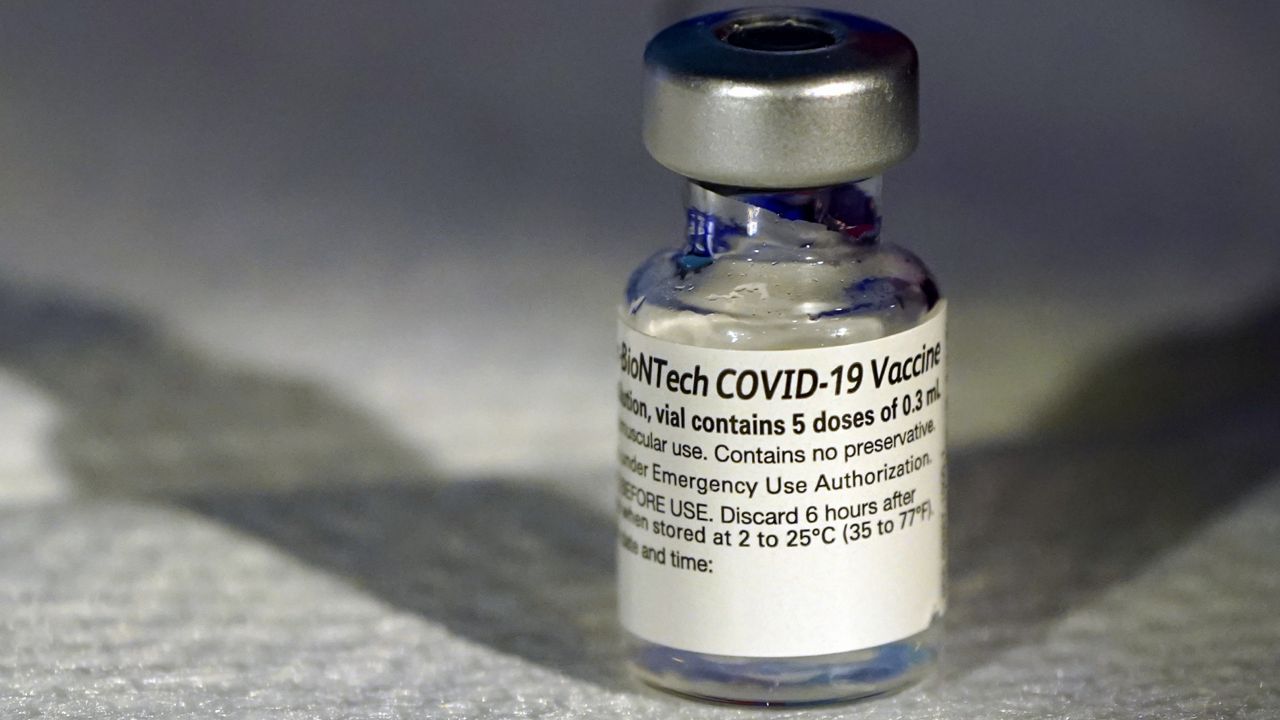
Вакцина Pfizer-BioNTech COVID-19 (тозінамеран), що продається під торговою маркою Comirnaty, є вакциною COVID-19 на основі мРНК. Дозволена для використання людям віком від 12 років для забезпечення захисту від інфекції вірусом SARS-CoV-2, який викликає COVID-19. Німецька компанія BioNTech розробила вакцину та співпрацювала з американською компанією Pfizer для підтримки клінічних випробувань, логістики та виробництва. У Китаї компанія BioNTech співпрацює з китайською компанією Fosun Pharma щодо розробки, збуту та розповсюдження прав, а вакцина розповсюджується як Fosun-BioNTech COVID-19. Вакцина вводиться внутрішньом’язово. Вона складається з модифікованої нуклеозидами мРНК (modRNA), що кодує мутовану форму повної довжини спайкового білка SARS-CoV-2, який інкапсульований у наночастинки ліпідів. Вакцинація вимагає двох доз з інтервалом у три тижні.
Європейський регулятор медичних препаратів 17 травня рекомендував продовжити термін зберігання вакцини Pfizer-BioNTech (PFE.N), (22UAy.DE) COVID-19 при нормальних температурах холодильника до 31 дня з п'яти днів, полегшуючи логістичні проблеми під час розгортання вакцинації в регіоні.
Зміна застосовується до невідкритих флаконів, повідомило Європейське агентство з лікарських засобів (EMA), додавши, що поради комітету з лікарських засобів для людини надані після оцінки додаткових даних дослідження стабільності, представлених Pfizer та BioNTech.
Найпоширеніші поширені реакції:
- головний біль;
- болі в суглобах;
- болі в м'язах;
- біль у місці ін'єкції;
- утома;
- озноб;
- гарячка;
- набряк у місці ін'єкції.
Також можливі менш поширені побічні реакції.
Побічні ефекти можуть виникати частіше після другої дози вакцини.
CoronaVac
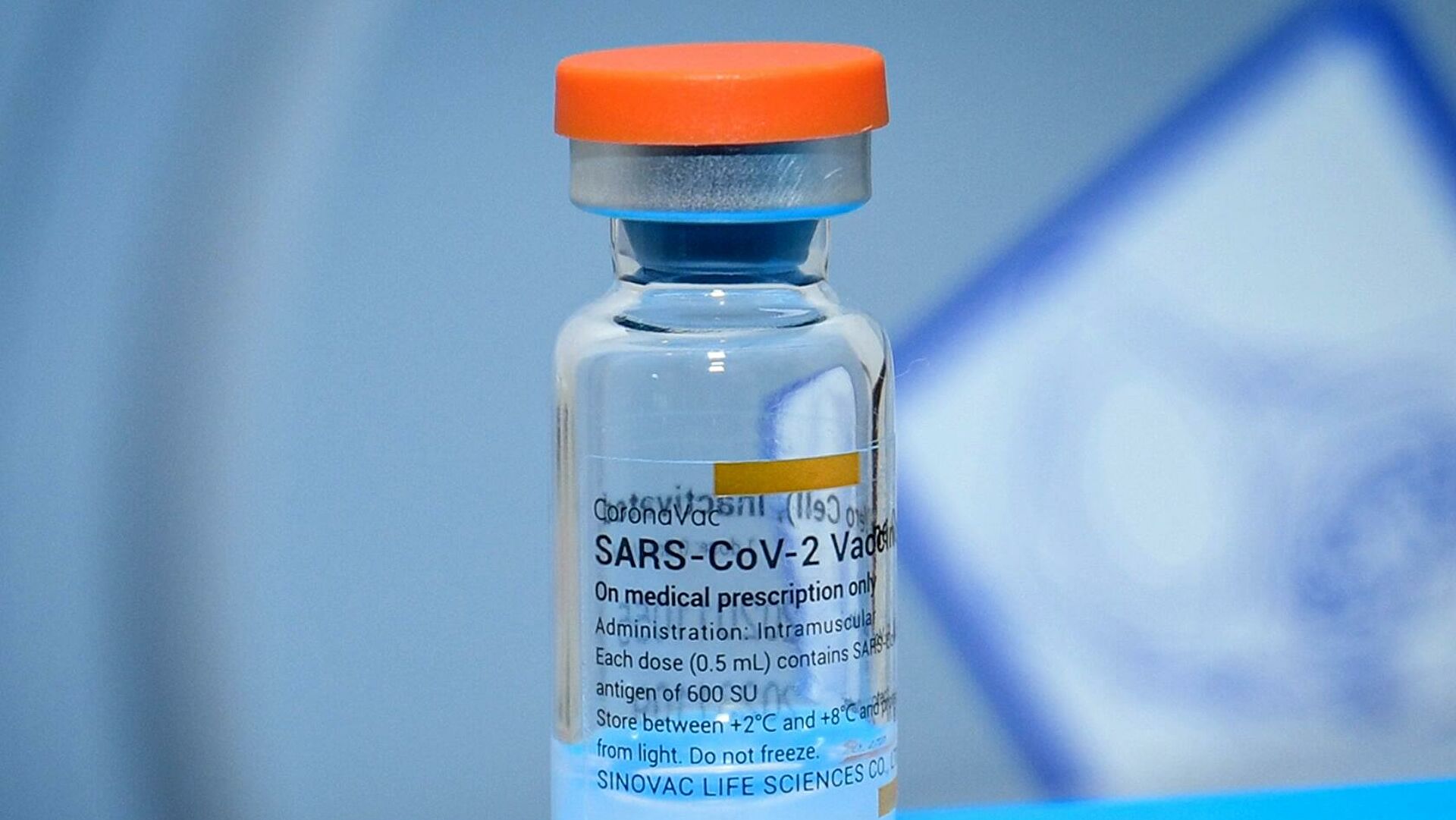
CoronaVac, також відома як вакцина Sinovac COVID-19, — це інактивована вакцина проти COVID-19, розроблена китайською компанією Sinovac Biotech. Спирається на традиційну технологію, подібну до BBIBP-CorV та BBV152, інших вакцин проти інактивованого вірусу COVID-19. CoronaVac не потрібно заморожувати, і як вакцину, так і сировину для формулювання нових доз можна транспортувати та охолоджувати при температурі 2–8 °C, температурі, при якій зберігаються вакцини проти грипу.
Реальне дослідження мільйонів чилійців, які отримали CoronaVac, виявило її ефективність на 65% проти симптоматичного COVID-19, 87% проти госпіталізації, 90% проти госпіталізації та 86% проти смерті. В Індонезії дані реальних досліджень показали, що 94% прищеплених медичних працівників були захищені вакциною від симптоматичної інфекції, перевершуючи результати клінічних випробувань. Результати випробувань фази III з Бразилії раніше показали ефективність запобігання симптоматичним інфекціям на 50,7% та ефективність у профілактиці легких випадків, що потребують лікування, на 83,7%. Ефективність проти симптоматичних інфекцій зросла до 62,3% з інтервалом 21 день і більше між дозами. Результати заключної фази III з Туреччини, оголошені 3 березня 2021 року, показали ефективність 84%.
Політизація, питання прозорості та деякі неповні судові дані в Бразилії сприяли відсутності довіри до CoronaVac там.
CoronaVac використовується у вакцинаційних кампаніях певних країн Азії, Південної Америки, Північної Америки, та Європи. У квітні 2020 року компанія Sinovac мала виробничу потужність 2 мільярди доз на рік і виробила 300 мільйонів загальних доз. В даний час вакцина виробляється на кількох заводах у Китаї, також заплановане закордонне виробництво в Бразилії у вересні 2021 р. та, як було нещодавно анонсовано, у Єгипті.
Технологія
Як інактивована вакцина, схожа з BBIBP-CorV та BBV152, CoronaVac використовує більш традиційну технологію, подібну до інактивованої вакцини проти поліомієліту. Спочатку для вирощування великої кількості вірусу за допомогою клітин vero використовували зразок SARS-CoV-2 з Китаю. Потім віруси просочуються бета-пропіолактоном (органічна сполука сімейства лактонових з чотиричленним кільцем, безбарвна рідина з трохи солодкуватим запахом, добре розчинна у воді та змішується з етанолом, ацетоном, діетиловим ефіром та хлороформом), який дезактивує їх, зв’язуючись з генами, залишаючи цілими інші вірусні частинки. Потім отримані інактивовані віруси змішують з ад'ювантом (в імунології ад’ювант — це речовина, яка підвищує та/або модулює імунну відповідь на вакцину) на основі алюмінію.
CoronaVac не потрібно заморожувати, і як вакцину, так і сировину для формулювання нових доз можна транспортувати та охолоджувати при температурі 2–8 °C, температурі, при якій зберігаються вакцини проти грипу. CoronaVac може зберігати стабільність до трьох років при зберіганні, що може забезпечити певну перевагу при розподілі вакцин у регіонах, що розвиваються.
.png)



За матеріалами Вікіпедії, ВООЗ, Reuters, BBC, МОЗ України